Immunologie des tumeurs

L’immunologie des tumeurs (appelée aussi immunologie anti-tumorale ou immuno-oncologie) et son but, l'immunothérapie des cancers, sont une branche de la biologie et de la médecine qui consiste à étudier les relations entre une tumeur et le système immunitaire de l'hôte, afin de concevoir des traitements anticancéreux capables d'exploiter la puissance potentielle d'une réaction immunitaire dirigée contre la tumeur. Ce domaine est au carrefour de divers domaines de la biologie nécessitant une compréhension particulière ainsi qu'une approche intégrée des connaissances : l'étude du micro-environnement tumoral, des différentes sous-populations de leucocytes présents dans une zone tumorale à un stade déterminé, des facteurs de transcription activés chez ces diverses cellules, des sous-types tumoraux pouvant influencer la réponse immune… sont autant de paramètres essentiels à décrire. La mise en évidence de nombreux acteurs moléculaires fondamentaux de régulation de la réponse immune durant ces 20 dernières années a révolutionné l'immunothérapie dans la lutte contre le cancer, avec le développement de nouvelles thérapies prometteuses, mais avec des applications dans d'autres domaines de l'immunologie[2].
L'immunothérapie contre le cancer est de plus en plus basée sur le développement de thérapies ciblées en fonction des types tumoraux ; les cellules cancéreuses expriment très souvent des macromolécules membranaires (protéines, dans la majorité des cas) détectables par divers agents du système immunitaire, nommées antigènes tumoraux (tels NY-ESO-1, MAGE-A, etc.). Les antigènes tumoraux permettent une discrimination efficace des cellules tumorales par le système immunitaire et laissent ainsi l'espoir d'une thérapie ciblée et n'occasionnant que très peu de dégâts dans les tissus sains alentour, consistant en une "forme active" de l'immunothérapie. L'immunothérapie dite "passive" a davantage pour objectif de stimuler une réponse immune antitumorale préexistante par l'utilisation d'anticorps monoclonaux ou de cytokines.
Historique
[modifier | modifier le code]La première preuve que l'immunothérapie peut être appliquée pour obtenir une régression tumorale a émergé des travaux de William Coley, qui, dans les années 1890, a obtenu une régression tumorale chez certains patients atteints de sarcome/lymphome après l'injection intra-tumorale de cultures de streptocoques (fourni par Robert Koch)[3],[4]. Au cours des 43 années suivantes, Coley a injecté à près de 900 patients (principalement des sarcomes) sa préparation bactérienne (obtenant un taux de guérison de plus de 10 %), connue plus tard sous le nom de toxine de Coley[3],[4] . Cependant, la toxine de Coley a fait l’objet d’un examen minutieux en raison d’une toxicité élevée et de certaines difficultés à reproduire les taux de rémission . Finalement, la première preuve expérimentale que les tumeurs non liées au virus peuvent effectivement être reconnues par le système immunitaire de l'hôte est apparue dans les années 1940, et dans les années 1960, couplées à la découverte des cellules T, il a été proposé que le système immunitaire humain puisse également réagir contre tumeurs[5]. La capacité des thérapies anticancéreuses à améliorer le potentiel immunogène des cellules malignes a été quelque peu appréciée dans les années 1970 . Il a été reconnu que si des traitements spécifiques sont appliqués (par exemple, radiothérapie, bacille de Calmette-Guérin ou certaines chimiothérapies), l’immunogénicité des cellules malignes augmente suffisamment pour induire une immunité antitumorale durable[6],[7],[8].
Hétérogénéité des tumeurs
[modifier | modifier le code]Pendant longtemps, les tumeurs ont été considérées comme des entités très homogènes résultant de l’expansion clonale d’une seule cellule présentant des défauts génétiques ou épigénétiques spécifiques[9]. Il est désormais clair que les cancers hématopoïétiques et solides sont très hétérogènes, non seulement parce que des cellules malignes présentant des caractéristiques phénotypiques et comportementales distinctes coexistent généralement, mais également parce que de multiples cellules non transformées sont récupérées par les cancers en croissance pour répondre à leurs besoins. Cela est particulièrement vrai pour les tumeurs solides, qui contiennent un compartiment cellulaire non malin abondant comprenant des composants stromaux, endothéliaux et immunitaires[10],[11]. Le compartiment immunitaire de la masse tumorale est en soi très hétérogène, variant non seulement en fonction du type de tumeur, du stade et du schéma thérapeutique, mais également sur une base interindividuelle[12]. Les preuves accumulées au cours de la dernière décennie indiquent en effet que les tumeurs humaines se forment, progressent et répondent au traitement dans le contexte d'une interaction intime et bidirectionnelle avec le système immunitaire[13],[14]. Ainsi, les néoplasmes ne peuvent se développer que lorsqu’ils sont capables d’échapper à l’immunosurveillance[15],[16], et ce en évoluant sous la pression sélective imposée par le système immunitaire. De plus, la composition, la densité et la localisation intratumorale de l’infiltrat immunitaire ont été attribuées à une valeur pronostique ou prédictive solide dans plusieurs cohortes de patients atteints de cancer[17],[18],[19]. Enfin, l’efficacité de la plupart, sinon de la totalité, des schémas thérapeutiques couramment utilisés chez les patients atteints de cancer a été étiologiquement liée à la réorientation d’une réponse immunitaire adaptative ciblant les cellules malignes[20].
Action immunologique des traitements du cancer
[modifier | modifier le code]La plupart des traitements anti-cancéreux par rayonnement ionisant ou chimiothérapie sont considérés comme aplasiants et immunosuppresseurs. Cependant, certains médicaments comme le cyclophosphamide[21] et la gemcitabine[22] sont capables d'éliminer préférentiellement des cellules immunitaires inhibitrices, respectivement les lymphocytes T régulateurs et les cellules myéloïdes suppressives. Par ailleurs, d'autres traitements chimiothérapeutiques, tels les anthracyclines[23] ou le bortezomib[24] sont quant à eux capables d'induire une mort tumorale immunogène, c'est-à-dire que les cellules tumorales tuées par ces médicaments sont pris en charge par les cellules présentatrices d'antigène et induisent une réponse immunitaire.
Il convient de résoudre ces problématiques liées aux effets des traitements sur le système immunitaire, qui est actuellement considéré comme un facteur clé dans la lutte contre le cancer[25]. Par ailleurs, l'étude des traitements anti-cancéreux et de leurs effets sur le système immunitaire soulève diverses interrogations essentielles quant à leur perfectionnement[26]. De nombreuses études considèrent que l'avenir du traitement du cancer réside dans une synergie totale et maîtrisée entre deux types de traitements tels que la chimiothérapie (pour affaiblir les cellules tumorales) puis l'immunothérapie (qui détruira les cellules tumorales précédemment affaiblies).
Immunologie des tumeurs
[modifier | modifier le code]En 2013, deux chercheurs ont décrit une série d’événements progressifs auto-entretenus, appelés cycle cancer-immunité, par lesquels les réponses immunitaires anticancéreuses conduisent à une élimination efficace des cellules cancéreuses [1]. L’existence de mécanismes de rétroaction négative développés par les tumeurs entrave ce cycle d’immunité contre le cancer et peut constituer un obstacle au développement de réponses cliniques efficaces.
Les sept étapes du cycle sont (1) libération d' antigènes par la cellule cancéreuse (2) Capture des antigènes par une cellule dendritque (3) Dans un ganglion lymphatique, présentation de l'antigène à un lymphocyte T CD8+ qui s'active et devient un lymphocyte T cytotoxique (4) Création d'une réserve de lymphocyte T cytotoxique dans la zone germinative (5) Migration des lymphocytes T cytotoxiques dans la tumeur (6) Reconnaissance de la cellule cancéreuse par le lymphocyte T (7) Destruction de la cellule cancéreuse par le lymphocyte T entrainant la libération d'antigène et le cycle recommence.
Déclenchement de la réponse immunitaire
[modifier | modifier le code]
Production des antigènes tumoraux
[modifier | modifier le code]Les antigènes spécifiques à la tumeur
[modifier | modifier le code]Les antigènes tumoraux qui s'expriment anormalement avec le développement et la progression des tumeurs sont le résultat d'anomalies au niveau des gènes, mais également en raison d'anomalies dans le processus de synthèse des antigènes [27]. Ces anomalies prennent du temps pour que les mutations s’accumulent dans les cellules somatiques normales jusqu’à ce qu’elles affectent les gènes cruciaux pour la prolifération et la mort cellulaire, conduisant finalement à la tumorigenèse. Pendant ce temps, les cellules somatiques normales peuvent également produire des antigènes tumoraux en raison de mutations dans les gènes liés à la tumeur, et même induire une immunité anti-tumorale (semblable à l'auto-immunité) dans des situations non tumorales [28] car l'équilibre entre les gènes pro oncogénique et suppresseur de tumeur est respecté [29]. Lorsque cet équilibre est rompu, la cellule produit des antigènes spécifiques à la tumeur (tumor-specific antigen ou TSA) ou néoantigène qui sont très immunogènes et spécifiques à la tumeur d'un individu [30].
Les mutations génétiques à l’origine de la cancérogenèse peuvent être divisées en mutation clés et un grand nombre de mutations transitoires. Théoriquement, plus le nombre de mutations est élevé, c'est-à-dire plus la charge de mutation tumorale est élevée, plus de gènes spécifiques à la tumeur seront produites, bien que toutes les mutations n'amélioreront pas la réponse immunitaire antitumorale [31]. De plus, la qualité de la mutation a également affecté la production de gènes spécifiques à la tumeur. Seules les mutations clés ont un effet sur la tumeur [32]. Les mutations du génome contribuent à la croissance tumorale chez 5 à 10 % des patients [33].
Les antigènes spécifiques à la tumeur jouent un rôle clé dans le déclenchement de l’immunité antitumorale et dans l’activation des lymphocytes T [34].
Les antigènes associées à la tumeur
[modifier | modifier le code]Une expression anormale des gènes normaux peut survenir dans les cellules tumorales [35]. Puisqu’il n’y a pas de changement de séquence génétique, les cellules tumorales produiront des antigènes que les cellules normales peuvent également exprimer, c’est-à-dire des antigènes associés aux tumeurs, qui ont une faible immunogénicité en raison de la formation d’une tolérance immunitaire. Les antigènes associés aux tumeurs comprennent l’antigène testiculaire cancéreux (Cancer/testis antigens), l’antigène différencié, l’antigène surexprimé et l’antigène carcinoembryonnaire [36]. Notamment, certains antigènes associés aux tumeurs peuvent également être dérivés de voies génétiques classiques, telles que la recombinaison de gènes qui réactive des promoteurs inhibés. Contrairement à d’autres antigènes associés aux tumeurs, certains antigènes carcinoembryonnaires réexprimés ultérieurement présentent encore une immunogénicité élevée car l’expression de protéines embryonnaires normales précède la formation d’une tolérance immunitaire [37].
Certains antigènes tumoraux favorisent l'apparition et le développement de tumeurs. Par exemple, certaines cellules cancéreuses du sein surexpriment le récepteur 2 du facteur de croissance épidermique améliorant la prolifération et la différenciation cellulaire [38]. L’équilibre entre la survie par les antigènes tumoraux et l’immunité antitumorale qu’ils provoquent détermine l’immunophénotype de la tumeur, y compris la sensibilité et la résistance à l’immunothérapie. Dans l’ensemble, les tumeurs ont tendance à cacher les antigènes spécifiques de la tumeur et à se faire passer pour des cellules normales en exprimant les antigènes associées aux tumeurs pour échapper au système immunitaire [39].
Production d'antigène microbien
[modifier | modifier le code]En plus des antigènes spécifiques de la tumeur et des antigènes associées aux tumeurs, des antigènes microbiens étrangers tels que des virus et des bactéries, peuvent également être utilisés comme antigènes tumoraux. Les antigènes microbiens activent l'immunité antimicrobienne tout en détruisant les cellules tumorales de l'hôte [40].
Le premier type d'antigènes provient du processus par lequel des cellules normales sont infectées et se transforment en cellules tumorales. L'autre type d'antigènes est exprimé après une infection spécifique de cellules tumorales, qui sont principalement exprimées par des bactéries génétiquement modifiées [41]. Dans des études récentes, les rétrovirus endogènes humains se sont révélés être plus actifs. Ils peuvent être réactivés par plusieurs facteurs, tels que des facteurs cancérigènes environnementaux, qui peuvent piloter l’expression d’oncogènes et activer l’immunité innée anti-tumorale en induisant des voies de défense virales [42].
Production d'antigène cellulaire interne : motif moléculaire associé aux dommages
[modifier | modifier le code]Les cellules immunitaires du système adaptatif doivent être capables de reconnaître les antigènes tumoraux afin d’initier l’immunité tumorale car le système immunitaire n’est pas capable de reconnaitre une cellule cancéreuse. Les cellules immunitaires qui patrouillent dans le système sanguin et lymphatique pour augmenter les risques de contact avec les antigènes tumoraux sont principalement des lymphocytes T et lymphocytes B à mémoire, dont le rôle premier est de maintenir l’immunité à long terme plutôt que d’initier l’immunité initiale [43]. Les cellules tumorales peuvent cacher les antigènes tumoraux en réduisant et en modifiant l’expression du complexe majeur d’histocompatibilité , et en se différenciant progressivement en phénotypes moins immunogènes [44].
Cependant, la prolifération tumorale incontrôlée exige des ressources importantes rarement fournis par l'environnement tumoral et l’approvisionnement local en ressources entraînant l’accumulation de déchets métaboliques, tels que l’hypoxie, la carence en glucose, l’accumulation d’acide lactique et le stress oxydatif. Cette situation aboutit inévitablement à des dommages, tels que le stress du réticulum endoplasmique , à la sénescence cellulaire et à la mort cellulaire régulatrice non apoptotique , en particulier la mort cellulaire immunogène [45]. La mort des cellules tumorales libère des antigènes internes à la tumeur, de l'adénosine triphosphate et de la protéine du groupe 1 à haute mobilité ainsi que d'autres stimulateurs immunitaires. De même, les cellules tumorales mourantes peuvent également exprimer des motifs moléculaires associés aux dommages, tels que la calréticuline et la protéine de choc thermique , qui attirent et activent les cellules immunitaires innées en se liant aux récepteurs de reconnaissance de formes [46]. Les cellules tumorales sénescentes sécrètent également un cocktail de cytokines pro-inflammatoires pour former le phénotype sécrétoire associé à la sénescence, qui à son tour régule le microenvironnement tumoral. Les modifications de la proportion de cellules sénescentes dans les tumeurs avant et après le traitement ont été reconnues comme l'un des marqueurs du cancer [47].
La mort des cellules tumorales constitue un marqueur important pour la libération d’antigènes internes de la tumeur et le déclenchement de la réaction immunitaire. Il est souvent utilisé comme cible clinique pour développer diverses stratégies thérapeutiques pour induire une mort cellulaire régulée non apoptotique dans les tumeurs, telles que les inducteurs de mort cellulaire immunogène [48]. Cependant, cela n'explique pas pourquoi les cellules tumorales saines au début du microenvironnement tumoral peuvent être reconnues par le système immunitaire lorsque les ressources sont suffisantes [49]. Cependant, la mort ou la lésion des cellules tumorales ne déclenche pas toujours une réponse immunitaire antitumorale et peut même supprimer l’immunité tumorale. Étant donné que la mort cellulaire se produit souvent à l’intérieur du tissu tumoral, il est possible que les débris cellulaires soient enfouis dans le microenvironnement tumoral et ne puisse pas être détecté par les cellules immunitaires [50]. Même si l’infiltration immunitaire est activée, la plupart des cellules tumorales peuvent cacher leurs propres antigènes et un grand nombre de cellules immunitaires infiltrées peuvent phagocyter entrainant une élimination rapide des motifs moléculaires associés aux dégâts et des débris tumoraux. Cette élimination, rapide peut entraver le processus de présentation de l’antigène induisant une tolérance immunitaire [51].
Les débris tumoraux peuvent également influencer le microenvironnement tumoral. Par exemple, les ions potassium libérés après la mort des cellules tumorales peuvent inhiber l’effet antitumoral des lymphocytes T effectrices [52]. La prostaglandine E2 libérée peut également inhiber l'activation des motifs moléculaires associés aux dégâts sur les macrophages et les cellules dendritiques [53]. De même, la protéine du groupe 1 à haute mobilité libérée après la mort par ferroptose induit la polarisation des macrophages de type M2 en se liant au récepteur RAGE [54]. En outre, la forte expression de CD39 et CD73 dans le microenvironnement tumoral peut convertir l'adénosine triphosphate immuno-activé en adénosine immunosuppressive, formant ainsi un mécanisme de rétroaction négative de l'axe énergétique de l'adénosine propice au développement de la tumeur [55].La mort d'une cellule tumorale alerte les autres cellules tumorales.. Semblables aux cellules immunitaires innées, les cellules tumorales peuvent également exprimer des rRécepteur de reconnaissance de motifs moléculaire stels que les récepteurs de type Toll et les récepteurs purinergiques pour reconnaître les motifs moléculaires associés aux dommages telles que l'adénosine triphosphate. Ils peuvent ensuite activer des voies de signalisation telles que NF-κB et la voie de signalisation MAPK/ERK , qui favorisent la prolifération des cellules tumorales et résistent à la mort. De plus, il induit la production de divers facteurs inflammatoires et de chimiokines pour réguler la différenciation et le recrutement des cellules immunitaires [56].
Mise en route de l'immunité innée
[modifier | modifier le code]
Le premier rôle l'immunité innée consiste à attaquer les cellules tumorales directement notamment les cellules tueuses naturelles et les macrophages. Le second rôle est d' activer l’immunité adaptative, impliquant principalement les cellules dendritiques via la présentation d’antigènes [57]. Afin de contrer la réponse immunitaire innée, les cellules tumorales peuvent perturber directement la formation des cellules immunitaires innées dans la moelle osseuse, en inhibant la maturation des cellules dendritiques , des granulocytes et des macrophages et recruter des cellules myéloïdes suppressives [58].
Lymphocyte NK
[modifier | modifier le code]Les lymphocytes NK sont des cellules avec des marqueurs de surface CD3- CD19- CD56 + et CD16+ (CD3 est un marqueur des lymphocytes T et CD19 est un marqueur des lymphocytes B) et le facteur de transcription nucléaire E4BP4+. Selon la différence d'expression de CD56, les cellules NK peuvent être divisées en CD56dim, qui joue principalement un rôle cytotoxique, et CD56bright, qui joue principalement un rôle immunomodulateur [59]. Compte tenu de l’hétérogénéité significative de l’infiltration des cellules NK dans les tumeurs, la fréquence des cellules NK prédit l’efficacité des immunothérapies telles que le récepteur de mort anti-programmé-1 [60]. Contrairement aux lymphocytes T, les cellules NK n'expriment pas de complexe majeur d'histocompatibilité, mais régulent leur activité cytotoxique principalement par l'équilibre d'une série de récepteurs activateurs (AKR) et de récepteurs inhibiteurs (IKR)). Les cellules NK ne nécessitant pas de présentation d’antigène, elles ont nt un effet antitumoral à spectre plus large, rapide et sûr [61]. Par conséquent, les récepteurs activateurs et inhibiteurs peuvent être utilisés comme points de contrôle immunitaires associés aux cellules NK.
En général, les molécules non complexe majeur d'histocompatibilité de type I à la surface de la tumeur activent les cellules NK après liaison avec les récepteurs activateurs, tandis que les complexes majeurs d'histocompatibilité de type I inhibent les cellules NK après liaison avec les récepteurs inhibiteurs, mais les complexes majeurs d'histocompatibilité de type I peuvent également activer les récepteurs activateurs [62].
Afin d'éviter la reconnaissance par les lymphocytes T, les cellules tumorales régulent généralement à la baisse l'expression du complexe majeur d'histocompatibilité de type I ou présentent des mutations génétiques de l'antigène leucocytaire humain responsable de la synthèse des complexes majeurs d'histocompatibilité et de la microglobuline β2 . La perte du complexe majeur d'histocompatibilité de type I entrainera la destruction par les cellules NK, c’est-à-dire l’effet « manque de soi », mais ce processus peut être perturbé. En raison de l'influence du microenvironnement tumoral, le nombre de cellules NK infiltrées dans la tumeur est moindre, en particulier les sous-groupes présentant des effets cytotoxiques [63]. De plus, les cellules tumorales peuvent réguler l’équilibre des récepteurs activateurs et des récepteurs inhibiteurs pour maintenir les cellules NK dans un état inhibé [64].
Macrophage
[modifier | modifier le code]Les macrophages dans les tumeurs dérivent principalement de monocytes circulants et de macrophages résidant dans les tissus, qui forment tous deux des macrophages associés aux tumeurs sous l'influence du microenvironnement tumoral [65]. Au stade précoce de la réponse immunitaire, le macrophage associé aux tumeurs a un profil de type M1 pro-inflammatoire joue principalement un rôle tueur, avec une expression élevée de CD80, CD86, le complexe majeur d'histocompatibilité de type II, de lOxyde nitrique synthase inductible , de CD68 et dépend de la glycolyse. Au stade ultérieur de la réponse immunitaire, le macrophage associé aux tumeurs a un profil de type M2 et joue principalement un rôle immunosuppresseur, exprimant fortement CD206, CD204, le facteur de croissance endothélial vasculaire , CD163 et l'arginase , et s'appuye sur la lipolyse pour la fourniture d'énergie [66]. La proportion des macrophages associés aux tumeurs est liée à la réponse à l'immunothérapie tumorale [67]. Semblable aux cellules NK, le macrophages associés aux tumeurs régule l’état d’activation principalement par l’équilibre d’une série de signaux « mange-moi » et « ne me mange pas » qui agissent comme des inhibiteurs de point de contrôle. Par exemple, les motifs moléculaires associés aux dommages exprimés par les cellules tumorales transmettent un signal « mange-moi » aux macrophages, tandis que les le complexe majeur d'histocompatibilité de type I exprimés par les cellules tumorales transmettent un signal « ne me mange pas » [68].
Mise en route de l'immunité adaptative
[modifier | modifier le code]Seules les cellules dendritiques peuvent activer les lymphocytes T dans les ganglions lymphatiques drainant la tumeur pour initier une réponse immunitaire adaptative [69]. Les cellules dendritiques immatures ont une expression élevée des récepteurs de reconnaissance de motif moléculaire mais une faible expression des complexes majeurs d'histocompatibilité, des molécules de co-stimulation et d'adhésion, de sorte qu'elles ont une forte capacité d'absorption et de traitement de l'antigène mais une faible capacité à présenter l'antigène. Au cours du processus de migration vers le ganglion lymphatique, les cellules dendritiques mûrissent progressivement avec une augmentation de l'expression des complexes majeurs d'histocompatibilité [70]. Les tumeurs freinent la maturation des cellules dendritiques par le biais du microenvironnement tumorale immunosuppresseurs, en particulier de composants liés à la matrice extracellulaire tumorale. La présentation des antigènes tumoraux peut être inhibée par des mécanismes tels que la mort cellulaire induite par l’activation des lymphocytes T dépendants des cellules dendritiques [71].
Influence du microenvironnement tumoral sur l'immunité
[modifier | modifier le code]Le microenvironnement tumoral, du fait de son hétérogénéité, possède des capacités immunosuppressives relativement étudiées. Ainsi, divers phénomènes relatifs à la progression tumorale, à savoir l'angiogenèse tumorale ou encore la transition épithélio-mésenchymateuse, ont été décrits pour leurs liens avec les capacités immunosuppressives de la tumeur.
Ainsi, il a par exemple été montré chez la souris que le sunitinib, un agent anti-angiogénique permettant d'inhiber la signalisation des récepteurs du
VEGF, PDGF, SCF et FLT-3L (facteurs de croissance nécessaires à l'angiogenèse mais aussi au développement tumoral de façon plus globale), avait également comme effet de diminuer la concentration en lymphocytes T CD4+ régulateurs au sein du site tumoral[72], suggérant une influence importante des voies de l'angiogenèse sur la modulation de la réponse immune anti-tumorale[73].
D'autres champs de recherche sont également explorés : si la contribution des fibroblastes associés aux tumeurs (CAF : Cancer Associated Fibroblasts) dans le développement tumoral semble ne faire aucun doute[74], le rôle immunosuppresseur de ces fibroblastes au sein même du micro-environnement tumoral reste moins connu. L'identification des acteurs moléculaires spécifiques de ces fibroblastes pourrait à terme mener à l'identification de nouvelles cibles thérapeutiques.

En parallèle, de nombreux projets de recherche se concentrent sur l'étude de la biologie des cellules immunitaires infiltrant les tumeurs. Parmi elles, on retrouve notamment :
- Les macrophages associés aux tumeurs : les monocytes sanguins sont capables d'infiltrer les tumeurs et d'évoluer en macrophages pouvant phagocyter des cellules tumorales et réaliser ensuite une présentation antigénique afin d'activer ou stimuler la réponse immunitaire adaptative. Il a été montré que les macrophages infiltrant les tumeurs (TIM : Tumor Infiltrating Macrophages) pouvaient évoluer en fonction du stade tumoral, du lieu de présence et en fonction de nombreux autres paramètres encore débattus. Ainsi, il existe plusieurs phénotypes de macrophages tumoraux nommés M1 et M2 (dont M2a, b, c) qui ont des fonctions pro-inflammatoires ou anti-inflammatoires, et ainsi, dans un contexte tumoral, pro ou anti-tumoral. Ainsi, une tumeur peut utiliser les macrophages par divers moyens pour créer un environnement favorable à son développement[75].
- Les lymphocytes T CD4+ régulateurs : ce type cellulaire est actuellement tout aussi exploré. Ces cellules ont la capacité d'inhiber ou au moins de participer à une régulation négative puissante du système immunitaire, à travers la sécrétion de TGF-β, d'IL-10 et de Fgl2. Les tumeurs, à travers divers moyens, peuvent activer les lymphocytes T régulateurs afin d'inhiber l'immunité innée et adaptative anti-tumorale.
Immunosurveillance
[modifier | modifier le code]
L'immunosurveillance énonce que tout au long de la vie, des cellules tumorales sont éliminées par le système immunitaire. l'interaction entre immunité et tumeur suivrait trois phases[76],[77] :
- élimination : les tumeurs sont détruites ;
- équilibre : un équilibre dynamique permet que des cellules tumorales sont gardées sous contrôle sans être détruites : c'est la dormance tumorale;
- échappement : Les cellules tumorales échappent au contrôle par le système immunitaire.
Il existe cependant des indices expérimentaux chez la souris. Ainsi, en injectant du méthylcholanthrène, un puissant carcinogène dans des souris, il est possible d'induire des cancers. Mais si on utilise une dose faible, la plupart des souris ne développeront pas de cancer. Cependant, si on élimine les cellules T de ces souris avec un anticorps monoclonal, on constate que des tumeurs se révèlent cliniquement. Ceci est donc un argument en faveur de l'existence de tumeur cryptiques, tenues sous contrôle du système immunitaire, et qui prolifèrent brusquement lorsque la pression immunitaire se relâche[78].
Immunothérapie des tumeurs
[modifier | modifier le code]
On dénombre 4 grandes stratégies d'immunothérapie des cancers ; toutes ont fait leurs preuves en matière d'efficacité dans la réduction du volume tumoral, à travers de très nombreux essais cliniques, mais il convient désormais de cibler les patients en fonction des types d'immunothérapie les plus appropriés selon leur cancer ainsi que d'autres paramètres (médecine personnalisée) :
- Immunothérapie non spécifique : c'est une des méthodes d'immunothérapies les plus simples, mais aux résultats modérés. Il s'agit d'injecter des cytokines permettant d'améliorer la réponse immune anti-tumorale, voire de permettre la régression tumorale (Interleukine 2 et IFN-γ).
- Immunothérapie par anticorps monoclonaux : c'est actuellement l'une des stratégies aux résultats des plus encourageants : des anticorps monoclonaux, ciblant des points de contrôle et de régulation du système immunitaire, permettent de bloquer l'inhibition (par la tumeur) de l'immunité anti-tumorale. L'utilisation d'anticorps comme le Nivolumab ou le Pembrolizumab, dans le ciblage de la molécule PD-1 sont les molécules rencontrant le plus de succès.
- Immunothérapie spécifique « adoptive » : cette stratégie repose sur le prélèvement des cellules T autologues, donc issus du sang (ou du site tumoral) du patient cancéreux, afin de les reprogrammer génétiquement en laboratoire pour les rendre plus efficaces dans leurs fonctions effectrices anti-tumorales.
- Vaccination thérapeutique : cette méthode correspond à une stimulation du système immunitaire grâce à l'utilisation de lymphocytes T CD8+ programmés pour cibler directement des cellules porteuses d'antigènes tumoraux puissamment immunogéniques[79],[80].
Classification de l'immunothérapie des tumeurs
[modifier | modifier le code]Les immunothérapies anticancéreuses sont généralement classées comme « passives » ou « actives » en fonction de leur capacité à (ré)activer le système immunitaire de l'hôte contre les cellules malignes[81].
| Immunothérapie | Type |
|---|---|
| Anticorps monoclonaux ciblant les cellules tumorales | Passive |
| Transfert de cellules | Passive |
| Virus oncolytique | |
| Traitement par cellules dendritiques | |
| Vaccin basé sur l'ADN | Active |
| Vaccin basé sur des peptides. | Active |
| Stimulation cytokiniques. | Active |
| Modulation par les anticorps monoclonaux | |
| Inhibiteurs du métabolisme immunitaire de la suppresion de la réponse immunitaire | Active |
| Inducteurs de la mort cellulaire immunologique | Active |
| Stimulateur des récepteur de reconnaissance de motifs moléculaires | Active |
| Autres |
Immunothérapie passive
[modifier | modifier le code]Immunothérapie par anticorps monoclonaux
[modifier | modifier le code]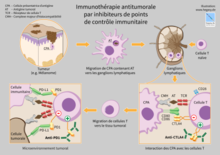
L'immunothérapie se concentre notamment autour de protéines de régulations du système immunitaire, nommées checkpoints du système immunitaire (immune checkpoints ou "points de contrôle du système immunitaire"). Parmi ces protéines, le CTLA-4, PD-1, ou encore TIGIT, qualifiées de rhéostats de la réponse immune[82] : ces molécules permettent entre autres le contrôle de la réponse immune adaptative du fait de leur expression par plusieurs sous-catégories de lymphocytes T (ainsi que d'autres cellules immunocompétentes). Ces molécules permettent une inactivation du système immunitaire et il a été montré que les tumeurs pouvaient, dans le cadre de leur stratégie de résistance et d'échappement tumoral face aux réactions immunes, inactiver la réponse immune anti-tumorale en « épuisant » les lymphocytes par une activation de leurs protéines d'inhibition que sont PD-1, CTLA-4 ou TIGIT (entre autres). Ces molécules sont la source d'un intérêt thérapeutique considérable dans l'espoir de développer des vaccins curatifs à partir d'anticorps monoclonaux inactivant ces protéines.
L'étude de ces divers facteurs de régulation puissante du système immunitaire reste malgré tout un vaste sujet de débat, quant à leur valeur pronostique et diagnostique dans un cadre clinique et de suivi des patients cancéreux. En effet, il a longtemps été considéré que la surexpression de la molécule PD-L1 dans les tumeurs n'était liée qu'à une mauvaise évolution du cancer, du fait de l'expression de cette protéine par les tumeurs. Seulement, l'expression de cette même protéine par diverses sous-populations de cellules du système immunitaire pourrait être un témoin d'une régulation correcte de la réponse immune anti-tumorale exacerbée et témoigner d'un parfait contrôle du système immunitaire sur le développement tumoral. De telles hypothèses restent en suspens et doivent être discutées et vérifiées afin d'adapter les futurs traitements et améliorer la réponse des patients aux divers médicaments en développement.
Il existe de nombreux essais d'immunothérapie des cancers, dont de nombreux traitements anti-cancéreux utilisant l'immunité chez la souris, et il n'est pas rare qu'ils soient couronnés de succès[83]. Mais en clinique humaine, à l'opposé, peu de stratégies sont effectivement des réussites. En effet, même si certaines études sur l'humain montrent des résultats encourageants[84], il reste à déterminer quels types de patients peuvent bénéficier du traitement et avec quelles doses (tous les patients traités ne répondent pas de la même manière au traitement, certains n'y répondent pas du tout). Par ailleurs, il convient également de travailler sur les effets secondaires : la sur-activation du système immunitaire par des traitements d'immunothérapie peut avoir de lourdes conséquences, notamment des récations auto-immunes ou inflammatoires puissantes. Dernièrement, on a obtenu des résultats assez bons pour un traitement du mélanome[85], et des cancers digestifs[86] ciblant les liaisons PD-L1 des tumeurs[87].
Des anticorps monoclonaux dirigés contre des antigènes de tumeur sont également de plus en plus expérimentés. C'est le cas par exemple pour le bevacizumab[88].
Influence du microbiote intestinal
[modifier | modifier le code]Une étude[89] de 2018, montre l'influence du microbiote intestinal sur l'efficacité de l'immunothérapie. En particulier, l'équipe a mis en évidence chez la souris que la bactérie Bacteroides fragilis contribuait à l’efficacité de l'anti-CLTA-4. De même, chez des patients traités avec du nivolumab (un anticorps dirigé contre le récepteur PD-1), l'efficacité du traitement est corrélée avec le taux d'une bactérie : Akkermansia muciniphila. En transférant à des souris axéniques une même tumeur et le microbiote de patients ayant répondu favorablement ou défavorablement au traitement, l'étude montre une amélioration de l'état des premières contrairement à celles dotées du mauvais microbiote[90].
Immunothérapie active
[modifier | modifier le code]Vaccination
[modifier | modifier le code]Transfert adoptif
[modifier | modifier le code]Il existe aussi des stratégies de transfert adoptif de cellules immunitaires manipulées ex vivo[91].
Virus oncolytique
[modifier | modifier le code]Cytokines dans l'immunothérapie des cancers
[modifier | modifier le code]Sources
[modifier | modifier le code]- Yang, K., Lu, R., Mei, J. et al. The war between the immune system and the tumor - using immune biomarkers as tracers. Biomark Res 12, 51 (2024). https://doi.org/10.1186/s40364-024-00599-5 publié sous license Creative Commons Attribution 4.0 International
Annexes
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Paradoxe de Peto
- William Coley (en) (1862-1936), cancérologue connu pour ses toxines de Coley, médecin du Memorial Sloan-Kettering Cancer Center (avant cette dénomination) connu pour son traitement de certains types de cancer (sarcome)[92], considéré hors de France comme un des pères de l'immunothérapie.
- Facteur de nécrose tumorale (1975)
Liens externes
[modifier | modifier le code]Notes et références
[modifier | modifier le code]Références
[modifier | modifier le code]- Daniel S. Chen et Ira Mellman, « Oncology Meets Immunology: The Cancer-Immunity Cycle », Immunity, vol. 39, no 1, , p. 1–10 (ISSN 1074-7613, DOI 10.1016/j.immuni.2013.07.012, lire en ligne, consulté le )
- Jin, Ahmed, Okazaki. 2011. Role of PD-1 in regulating T-cell immunity. Curr. Top. Microbiol. Immunol. 350: 17-37
- (en) Christopher R Parish, « Cancer immunotherapy: The past, the present and the future », Immunology & Cell Biology, vol. 81, no 2, , p. 106–113 (ISSN 0818-9641 et 1440-1711, DOI 10.1046/j.0818-9641.2003.01151.x, lire en ligne, consulté le )
- (en) Kangla Tsung et Jeffrey A. Norton, « Lessons from Coley's Toxin », Surgical Oncology, vol. 15, no 1, , p. 25–28 (DOI 10.1016/j.suronc.2006.05.002, lire en ligne, consulté le )
- (en) Pierre G. Coulie, Benoît J. Van den Eynde, Pierre van der Bruggen et Thierry Boon, « Tumour antigens recognized by T lymphocytes: at the core of cancer immunotherapy », Nature Reviews Cancer, vol. 14, no 2, , p. 135–146 (ISSN 1474-175X et 1474-1768, DOI 10.1038/nrc3670, lire en ligne, consulté le )
- Liao SK, Carr DH. Comparative immunogenicity of irradiated, neuraminidase treated, and fused cells of a strain-restricted sarcoma. Z Krebsforsch klin Onkol Cancer Res Clin Oncol (1974) 82(2):133–42.
- Milas L, Withers HR. Nonspecific immunotherapy of malignant tumors. Radiology (1976) 118(1):211–8
- Bogden AE, Esber HJ. Influence of surgery, irradiation, chemotherapy, and immunotherapy on growth of a metastasizing rat mammary adenocarcinoma. Natl Cancer Inst Monogr (1978) (49):97–100.
- (en) Douglas Hanahan et Robert A Weinberg, « The Hallmarks of Cancer », Cell, vol. 100, no 1, , p. 57–70 (DOI 10.1016/S0092-8674(00)81683-9, lire en ligne, consulté le )
- (en) T L Whiteside, « The tumor microenvironment and its role in promoting tumor growth », Oncogene, vol. 27, no 45, , p. 5904–5912 (ISSN 0950-9232 et 1476-5594, PMID 18836471, PMCID PMC3689267, DOI 10.1038/onc.2008.271, lire en ligne, consulté le )
- (en) Corbin E. Meacham et Sean J. Morrison, « Tumour heterogeneity and cancer cell plasticity », Nature, vol. 501, no 7467, , p. 328–337 (ISSN 0028-0836 et 1476-4687, PMID 24048065, PMCID PMC4521623, DOI 10.1038/nature12624, lire en ligne, consulté le )
- (en) Catherine Sautès-Fridman, Julien Cherfils-Vicini, Diane Damotte et Sylvain Fisson, « Tumor microenvironment is multifaceted », Cancer and Metastasis Reviews, vol. 30, no 1, , p. 13–25 (ISSN 0167-7659 et 1573-7233, DOI 10.1007/s10555-011-9279-y, lire en ligne, consulté le )
- (en) Robert D. Schreiber, Lloyd J. Old et Mark J. Smyth, « Cancer Immunoediting: Integrating Immunity’s Roles in Cancer Suppression and Promotion », Science, vol. 331, no 6024, , p. 1565–1570 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1203486, lire en ligne, consulté le )
- (en) Deepak Mittal, Matthew M Gubin, Robert D Schreiber et Mark J Smyth, « New insights into cancer immunoediting and its three component phases—elimination, equilibrium and escape », Current Opinion in Immunology, vol. 27, , p. 16–25 (PMID 24531241, PMCID PMC4388310, DOI 10.1016/j.coi.2014.01.004, lire en ligne, consulté le )
- (en) Laurence Zitvogel, Antoine Tesniere et Guido Kroemer, « Cancer despite immunosurveillance: immunoselection and immunosubversion », Nature Reviews Immunology, vol. 6, no 10, , p. 715–727 (ISSN 1474-1733 et 1474-1741, DOI 10.1038/nri1936, lire en ligne, consulté le )
- (en) Laura Senovilla, Lorenzo Galluzzi, Laurence Zitvogel et Guido Kroemer, « Immunosurveillance as a regulator of tissue homeostasis », Trends in Immunology, vol. 34, no 10, , p. 471–481 (DOI 10.1016/j.it.2013.06.005, lire en ligne, consulté le )
- (en) Wolf Herman Fridman, Franck Pagès, Catherine Sautès-Fridman et Jérôme Galon, « The immune contexture in human tumours: impact on clinical outcome », Nature Reviews Cancer, vol. 12, no 4, , p. 298–306 (ISSN 1474-175X et 1474-1768, DOI 10.1038/nrc3245, lire en ligne, consulté le )
- (en) Laura Senovilla, Erika Vacchelli, Jerome Galon et Sandy Adjemian, « Trial watch: Prognostic and predictive value of the immune infiltrate in cancer », OncoImmunology, vol. 1, no 8, , p. 1323–1343 (ISSN 2162-402X, PMID 23243596, PMCID PMC3518505, DOI 10.4161/onci.22009, lire en ligne, consulté le )
- (en) Laura Senovilla, Fernando Aranda, Lorenzo Galluzzi et Guido Kroemer, « Impact of myeloid cells on the efficacy of anticancer chemotherapy », Current Opinion in Immunology, vol. 30, , p. 24–31 (DOI 10.1016/j.coi.2014.05.009, lire en ligne, consulté le )
- (en) Lorenzo Galluzzi, Laura Senovilla, Laurence Zitvogel et Guido Kroemer, « The secret ally: immunostimulation by anticancer drugs », Nature Reviews Drug Discovery, vol. 11, no 3, , p. 215–233 (ISSN 1474-1776 et 1474-1784, DOI 10.1038/nrd3626, lire en ligne, consulté le )
- Ghiringhelli et al., European Jouranl of Immunology, vol. 34, pages 336-344, 2004.
- Suzuki et al., Clinical Cancer Research, vol. 11, pages 6713-6721, 2005.
- Apetoh et al., Trends in Molecular Medicine, vol. 14, pages 141-151, 2008.
- Spisek et al., Blood, vol. 109, pages 4839-4845, 2007.
- http://www.ipubli.inserm.fr/handle/10608/5849 - Salem Chouaib, Faten El Hage, Houssem Benlalam et Fathia Mami-Chouaib (Institut Gustave Roussy, Villejuif) : "Immunothérapie du cancer : espoirs et réalités" (2006)
- https://www.ncbi.nlm.nih.gov/pubmed/27030078 - "Immunological off-target effects of imatinib", Laurence Zitvogel, Sylvie Rusakiewicz, Bertrand Routy, Maha Ayyoub & Guido Kroemer, Nature, 2016.
- (en) Robert K. Bradley et Olga Anczuków, « RNA splicing dysregulation and the hallmarks of cancer », Nature Reviews Cancer, vol. 23, no 3, , p. 135–155 (ISSN 1474-1768, PMID 36627445, PMCID PMC10132032, DOI 10.1038/s41568-022-00541-7, lire en ligne, consulté le )
- (en) Ruoyan Li, Lin Di, Jie Li et Wenyi Fan, « A body map of somatic mutagenesis in morphologically normal human tissues », Nature, vol. 597, no 7876, , p. 398–403 (ISSN 1476-4687, DOI 10.1038/s41586-021-03836-1, lire en ligne, consulté le )
- Jing Liu, Yunhua Peng et Wenyi Wei, « Cell cycle on the crossroad of tumorigenesis and cancer therapy », Trends in Cell Biology, vol. 32, no 1, , p. 30–44 (ISSN 0962-8924, PMID 34304958, PMCID PMC8688170, DOI 10.1016/j.tcb.2021.07.001, lire en ligne, consulté le )
- (en) Zheying Zhang, Manman Lu, Yu Qin et Wuji Gao, « Neoantigen: A New Breakthrough in Tumor Immunotherapy », Frontiers in Immunology, vol. 12, (ISSN 1664-3224, PMID 33936118, PMCID PMC8085349, DOI 10.3389/fimmu.2021.672356, lire en ligne, consulté le )
- Jingyuan Wang, Joanne Xiu, Alex Farrell et Yasmine Baca, « Mutational analysis of microsatellite-stable gastrointestinal cancer with high tumour mutational burden: a retrospective cohort study », The Lancet Oncology, vol. 24, no 2, , p. 151–161 (ISSN 1470-2045, DOI 10.1016/s1470-2045(22)00783-5, lire en ligne, consulté le )
- Sushant Kumar, Jonathan Warrell, Shantao Li et Patrick D. McGillivray, « Passenger Mutations in More Than 2,500 Cancer Genomes: Overall Molecular Functional Impact and Consequences », Cell, vol. 180, no 5, , p. 915–927.e16 (ISSN 0092-8674, PMID 32084333, PMCID PMC7210002, DOI 10.1016/j.cell.2020.01.032, lire en ligne, consulté le )
- (en) Maxwell A. Sherman, Adam U. Yaari, Oliver Priebe et Felix Dietlein, « Genome-wide mapping of somatic mutation rates uncovers drivers of cancer », Nature Biotechnology, vol. 40, no 11, , p. 1634–1643 (ISSN 1546-1696, PMID 35726091, PMCID PMC9646522, DOI 10.1038/s41587-022-01353-8, lire en ligne, consulté le )
- (en) Jingjing He, Xinxin Xiong, Han Yang et Dandan Li, « Defined tumor antigen-specific T cells potentiate personalized TCR-T cell therapy and prediction of immunotherapy response », Cell Research, vol. 32, no 6, , p. 530–542 (ISSN 1748-7838, PMID 35165422, PMCID PMC9160085, DOI 10.1038/s41422-022-00627-9, lire en ligne, consulté le )
- (en) Marianne Burbage, Ares Rocañín-Arjó, Blandine Baudon et Yago A. Arribas, « Epigenetically controlled tumor antigens derived from splice junctions between exons and transposable elements », Science Immunology, vol. 8, no 80, (ISSN 2470-9468, DOI 10.1126/sciimmunol.abm6360, lire en ligne, consulté le )
- (en) Fangjun Chen, Zhengyun Zou, Juan Du et Shu Su, « Neoantigen identification strategies enable personalized immunotherapy in refractory solid tumors », The Journal of Clinical Investigation, vol. 129, no 5, , p. 2056–2070 (ISSN 0021-9738, PMID 30835255, PMCID PMC6486339, DOI 10.1172/JCI99538, lire en ligne, consulté le )
- (en) Tao Jiang, Tao Shi, Henghui Zhang et Jie Hu, « Tumor neoantigens: from basic research to clinical applications », Journal of Hematology & Oncology, vol. 12, no 1, , p. 93 (ISSN 1756-8722, PMID 31492199, PMCID PMC6731555, DOI 10.1186/s13045-019-0787-5, lire en ligne, consulté le )
- (en) Avisek Majumder, Manbir Sandhu, Debarko Banerji et Veronica Steri, « The role of HER2 and HER3 in HER2-amplified cancers beyond breast cancers », Scientific Reports, vol. 11, no 1, , p. 9091 (ISSN 2045-2322, PMID 33907275, PMCID PMC8079373, DOI 10.1038/s41598-021-88683-w, lire en ligne, consulté le )
- (en) Frank J. Lowery, Sri Krishna, Rami Yossef et Neilesh B. Parikh, « Molecular signatures of antitumor neoantigen-reactive T cells from metastatic human cancers », Science, vol. 375, no 6583, , p. 877–884 (ISSN 0036-8075 et 1095-9203, PMID 35113651, PMCID PMC8996692, DOI 10.1126/science.abl5447, lire en ligne, consulté le )
- (en) Reza Naghavian, Wolfgang Faigle, Pietro Oldrati et Jian Wang, « Microbial peptides activate tumour-infiltrating lymphocytes in glioblastoma », Nature, vol. 617, no 7962, , p. 807–817 (ISSN 1476-4687, PMID 37198490, PMCID PMC10208956, DOI 10.1038/s41586-023-06081-w, lire en ligne, consulté le )
- (en) Fernando P. Canale, Camilla Basso, Gaia Antonini et Michela Perotti, « Metabolic modulation of tumours with engineered bacteria for immunotherapy », Nature, vol. 598, no 7882, , p. 662–666 (ISSN 1476-4687, DOI 10.1038/s41586-021-04003-2, lire en ligne, consulté le )
- Johan Jakobsson et Michelle Vincendeau, « SnapShot: Human endogenous retroviruses », Cell, vol. 185, no 2, , p. 400–400.e1 (ISSN 0092-8674, DOI 10.1016/j.cell.2021.12.028, lire en ligne, consulté le )
- (en) Ute Koch et Freddy Radtke, « Mechanisms of T Cell Development and Transformation », Annual Review of Cell and Developmental Biology, vol. 27, no 1, , p. 539–562 (ISSN 1081-0706 et 1530-8995, DOI 10.1146/annurev-cellbio-092910-154008, lire en ligne, consulté le )
- (en) Domenico Ribatti, « The concept of immune surveillance against tumors: The first theories », Oncotarget, vol. 8, no 4, , p. 7175–7180 (ISSN 1949-2553, PMID 27764780, PMCID PMC5351698, DOI 10.18632/oncotarget.12739, lire en ligne, consulté le )
- (en) Guido Kroemer, Claudia Galassi, Laurence Zitvogel et Lorenzo Galluzzi, « Immunogenic cell stress and death », Nature Immunology, vol. 23, no 4, , p. 487–500 (ISSN 1529-2916, DOI 10.1038/s41590-022-01132-2, lire en ligne, consulté le )
- (en) Dmitri V. Krysko, Abhishek D. Garg, Agnieszka Kaczmarek et Olga Krysko, « Immunogenic cell death and DAMPs in cancer therapy », Nature Reviews Cancer, vol. 12, no 12, , p. 860–875 (ISSN 1474-1768, DOI 10.1038/nrc3380, lire en ligne, consulté le )
- (en) Ines Marin, Olga Boix, Andrea Garcia-Garijo et Isabelle Sirois, « Cellular Senescence Is Immunogenic and Promotes Antitumor Immunity », Cancer Discovery, vol. 13, no 2, , p. 410–431 (ISSN 2159-8274 et 2159-8290, PMID 36302218, PMCID PMC7614152, DOI 10.1158/2159-8290.CD-22-0523, lire en ligne, consulté le )
- (en) Guido Kroemer, Lorenzo Galluzzi, Oliver Kepp et Laurence Zitvogel, « Immunogenic Cell Death in Cancer Therapy », Annual Review of Immunology, vol. 31, no 1, , p. 51–72 (ISSN 0732-0582 et 1545-3278, DOI 10.1146/annurev-immunol-032712-100008, lire en ligne, consulté le )
- (en) Jiadi Lv, Yabo Zhou, Nannan Zhou et Zhenfeng Wang, « Epigenetic modification of CSDE1 locus dictates immune recognition of nascent tumorigenic cells », Science Translational Medicine, vol. 15, no 681, (ISSN 1946-6234 et 1946-6242, DOI 10.1126/scitranslmed.abq6024, lire en ligne, consulté le )
- (en) Fu Peng, Minru Liao, Rui Qin et Shiou Zhu, « Regulated cell death (RCD) in cancer: key pathways and targeted therapies », Signal Transduction and Targeted Therapy, vol. 7, no 1, , p. 1–66 (ISSN 2059-3635, PMID 35963853, PMCID PMC9376115, DOI 10.1038/s41392-022-01110-y, lire en ligne, consulté le )
- Jin Huang, Yangchun Xie, Xiaofang Sun et Herbert J. Zeh, « DAMPs, ageing, and cancer: The ‘DAMP Hypothesis’ », Ageing Research Reviews, vol. 24, , p. 3–16 (ISSN 1568-1637, PMID 25446804, PMCID PMC4416066, DOI 10.1016/j.arr.2014.10.004, lire en ligne, consulté le )
- (en) Robert Eil, Suman K. Vodnala, David Clever et Christopher A. Klebanoff, « Ionic immune suppression within the tumour microenvironment limits T cell effector function », Nature, vol. 537, no 7621, , p. 539–543 (ISSN 1476-4687, PMID 27626381, PMCID PMC5204372, DOI 10.1038/nature19364, lire en ligne, consulté le )
- Francesco Cilenti, Giulia Barbiera, Nicoletta Caronni et Dario Iodice, « A PGE2-MEF2A axis enables context-dependent control of inflammatory gene expression », Immunity, vol. 54, no 8, , p. 1665–1682.e14 (ISSN 1074-7613, PMID 34129840, PMCID PMC8362890, DOI 10.1016/j.immuni.2021.05.016, lire en ligne, consulté le )
- (en) Xin Chen, Rui Kang, Guido Kroemer et Daolin Tang, « Broadening horizons: the role of ferroptosis in cancer », Nature Reviews Clinical Oncology, vol. 18, no 5, , p. 280–296 (ISSN 1759-4782, DOI 10.1038/s41571-020-00462-0, lire en ligne, consulté le )
- (en) Gennady G. Yegutkin et Detlev Boison, « ATP and Adenosine Metabolism in Cancer: Exploitation for Therapeutic Gain », Pharmacological Reviews, vol. 74, no 3, , p. 799–824 (ISSN 0031-6997 et 1521-0081, PMID 35738682, PMCID PMC9553103, DOI 10.1124/pharmrev.121.000528, lire en ligne, consulté le )
- (en) Si Ming Man et Brendan J. Jenkins, « Context-dependent functions of pattern recognition receptors in cancer », Nature Reviews Cancer, vol. 22, no 7, , p. 397–413 (ISSN 1474-1768, DOI 10.1038/s41568-022-00462-5, lire en ligne, consulté le )
- (en) Laura Maiorino, Juliane Daßler-Plenker, Lijuan Sun et Mikala Egeblad, « Innate Immunity and Cancer Pathophysiology », Annual Review of Pathology: Mechanisms of Disease, vol. 17, no 1, , p. 425–457 (ISSN 1553-4006 et 1553-4014, PMID 34788549, PMCID PMC9012188, DOI 10.1146/annurev-pathmechdis-032221-115501, lire en ligne, consulté le )
- Haixia Long, Qingzhu Jia, Liuyang Wang et Wenfeng Fang, « Tumor-induced erythroid precursor-differentiated myeloid cells mediate immunosuppression and curtail anti-PD-1/PD-L1 treatment efficacy », Cancer Cell, vol. 40, no 6, , p. 674–693.e7 (ISSN 1535-6108, DOI 10.1016/j.ccell.2022.04.018, lire en ligne, consulté le )
- Justin T Gunesch, Amera L Dixon, Tasneem AM Ebrahim et Melissa M Berrien-Elliott, « CD56 regulates human NK cell cytotoxicity through Pyk2 », eLife, vol. 9, , e57346 (ISSN 2050-084X, PMID 32510326, PMCID PMC7358009, DOI 10.7554/eLife.57346, lire en ligne, consulté le )
- (en) Tobias Bald, Matthew F. Krummel, Mark J. Smyth et Kevin C. Barry, « The NK cell–cancer cycle: advances and new challenges in NK cell–based immunotherapies », Nature Immunology, vol. 21, no 8, , p. 835–847 (ISSN 1529-2916, PMID 32690952, PMCID PMC8406687, DOI 10.1038/s41590-020-0728-z, lire en ligne, consulté le )
- (en) Mubin Tarannum, Rizwan Romee et Roman M. Shapiro, « Innovative Strategies to Improve the Clinical Application of NK Cell-Based Immunotherapy », Frontiers in Immunology, vol. 13, (ISSN 1664-3224, PMID 35401529, PMCID PMC8990319, DOI 10.3389/fimmu.2022.859177, lire en ligne, consulté le )
- (en) Jacob A. Myers et Jeffrey S. Miller, « Exploring the NK cell platform for cancer immunotherapy », Nature Reviews Clinical Oncology, vol. 18, no 2, , p. 85–100 (ISSN 1759-4782, PMID 32934330, PMCID PMC8316981, DOI 10.1038/s41571-020-0426-7, lire en ligne, consulté le )
- (en) Céline Bossard, Stéphane Bézieau, Tamara Matysiak‐Budnik et Christelle Volteau, « HLA‐E/β2 microglobulin overexpression in colorectal cancer is associated with recruitment of inhibitory immune cells and tumor progression », International Journal of Cancer, vol. 131, no 4, , p. 855–863 (ISSN 0020-7136 et 1097-0215, DOI 10.1002/ijc.26453, lire en ligne, consulté le )
- (en) Branca I. Pereira, Oliver P. Devine, Milica Vukmanovic-Stejic et Emma S. Chambers, « Senescent cells evade immune clearance via HLA-E-mediated NK and CD8+ T cell inhibition », Nature Communications, vol. 10, no 1, , p. 2387 (ISSN 2041-1723, PMID 31160572, PMCID PMC6547655, DOI 10.1038/s41467-019-10335-5, lire en ligne, consulté le )
- (en) Yuanyuan An et Qing Yang, « Tumor‐associated macrophage‐targeted therapeutics in ovarian cancer », International Journal of Cancer, vol. 149, no 1, , p. 21–30 (ISSN 0020-7136 et 1097-0215, DOI 10.1002/ijc.33408, lire en ligne, consulté le )
- (en) Hui Wang, Tian Tian et Jinhua Zhang, « Tumor-Associated Macrophages (TAMs) in Colorectal Cancer (CRC): From Mechanism to Therapy and Prognosis », International Journal of Molecular Sciences, vol. 22, no 16, , p. 8470 (ISSN 1422-0067, PMID 34445193, PMCID PMC8395168, DOI 10.3390/ijms22168470, lire en ligne, consulté le )
- (en) Massimo Locati, Graziella Curtale et Alberto Mantovani, « Diversity, Mechanisms, and Significance of Macrophage Plasticity », Annual Review of Pathology: Mechanisms of Disease, vol. 15, no 1, , p. 123–147 (ISSN 1553-4006 et 1553-4014, PMID 31530089, PMCID PMC7176483, DOI 10.1146/annurev-pathmechdis-012418-012718, lire en ligne, consulté le )
- (en) David G. DeNardo et Brian Ruffell, « Macrophages as regulators of tumour immunity and immunotherapy », Nature Reviews Immunology, vol. 19, no 6, , p. 369–382 (ISSN 1474-1741, PMID 30718830, PMCID PMC7339861, DOI 10.1038/s41577-019-0127-6, lire en ligne, consulté le )
- (en) Stefanie K. Wculek, Francisco J. Cueto, Adriana M. Mujal et Ignacio Melero, « Dendritic cells in cancer immunology and immunotherapy », Nature Reviews Immunology, vol. 20, no 1, , p. 7–24 (ISSN 1474-1741, DOI 10.1038/s41577-019-0210-z, lire en ligne, consulté le )
- (en) Suchit Jhunjhunwala, Christian Hammer et Lélia Delamarre, « Antigen presentation in cancer: insights into tumour immunogenicity and immune evasion », Nature Reviews Cancer, vol. 21, no 5, , p. 298–312 (ISSN 1474-1768, DOI 10.1038/s41568-021-00339-z, lire en ligne, consulté le )
- (en) Douglas R. Green, Nathalie Droin et Michael Pinkoski, « Activation‐induced cell death in T cells », Immunological Reviews, vol. 193, no 1, , p. 70–81 (ISSN 0105-2896 et 1600-065X, DOI 10.1034/j.1600-065X.2003.00051.x, lire en ligne, consulté le )
- Hipp MM, et al. Blood 2008 ; 111 : 5610-20.
- http://www.jle.com/fr/VEGF/VEGF.SOM.29/13-16.pdf "Influence de l’angiogenèse et des traitements anti-angiogéniques sur la réponse immunitaire anti-tumorale et l’immunosuppression" - Pr. Eric Tartour, Paris, 2012
- http://curie.fr/actualites/comprendre-comment-cellule-tumorale-detourne-son-environnement-006647 Les différents types de fibroblastes associés aux tumeurs et leurs effets protumoraux ; Equipe du Pr. Fatima Mechta, Institut Curie - Paris
- http://www.cell.com/immunity/abstract/S1074-7613(14)00230-1
- Dunn et al., Immunity, vol. 21, pages 137-148, 2004.
- Dunn et al., Annual Reviews in Immunology, vol. 22, pages 329-360, 2004.
- Koebel et al., Nature, vol. 450, pages 930-937, 2008.
- « Faculté de Médecine Montpellier - Nîmes - Université de Montpellier », sur Faculté de Médecine Montpellier - Nîmes (consulté le ).
- (en) « Types of Cancer Immunotherapy », sur fightcancerwithimmunotherapy.com via Wikiwix (consulté le ).
- Lesterhuis WJ, Haanen JB, Punt CJ. Cancer immunotherapy--revisited. Nat Rev Drug Discov. 2011; 10:591-60
- (en) Oncology meets immunology: the cancer-immunity cycle. https://www.ncbi.nlm.nih.gov/pubmed/23890059
- Par exemple Berraondo et al., Cancer Research, vol. 67, pages 8847-8855, 2007.
- (en) Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. https://www.ncbi.nlm.nih.gov/pubmed/22658128
- "Congrès de l'ASCO 2015, Mélanomes : de meilleurs résultats avec les immunothérapies "-
- "Juillet 2015, GastroScoop: L’immunothérapie des cancers digestifs avance !".
- (en) "Anti–PD-1/PD-L1 therapy of human cancer, 37 s/1 min 23 s.
- H. Hurwitz H, et al., New England Journal of Medicine, vol. 350, pages 2335–2342, 2004.
- (en) Bertrand Routy et al., Gut microbiote influences efficacy of PD-1-based immunotherapy against epithelial tumors, Science, 359, 91, 2018.
- La Recherche n° 535, mai 2018.
- Hunder, New England Journal of Medicine, vol. 358, pages 2698-2703, 2008.
- « Ces cancers qui régressent spontanément », sur Réalités Biomédicales, (consulté le ).
